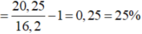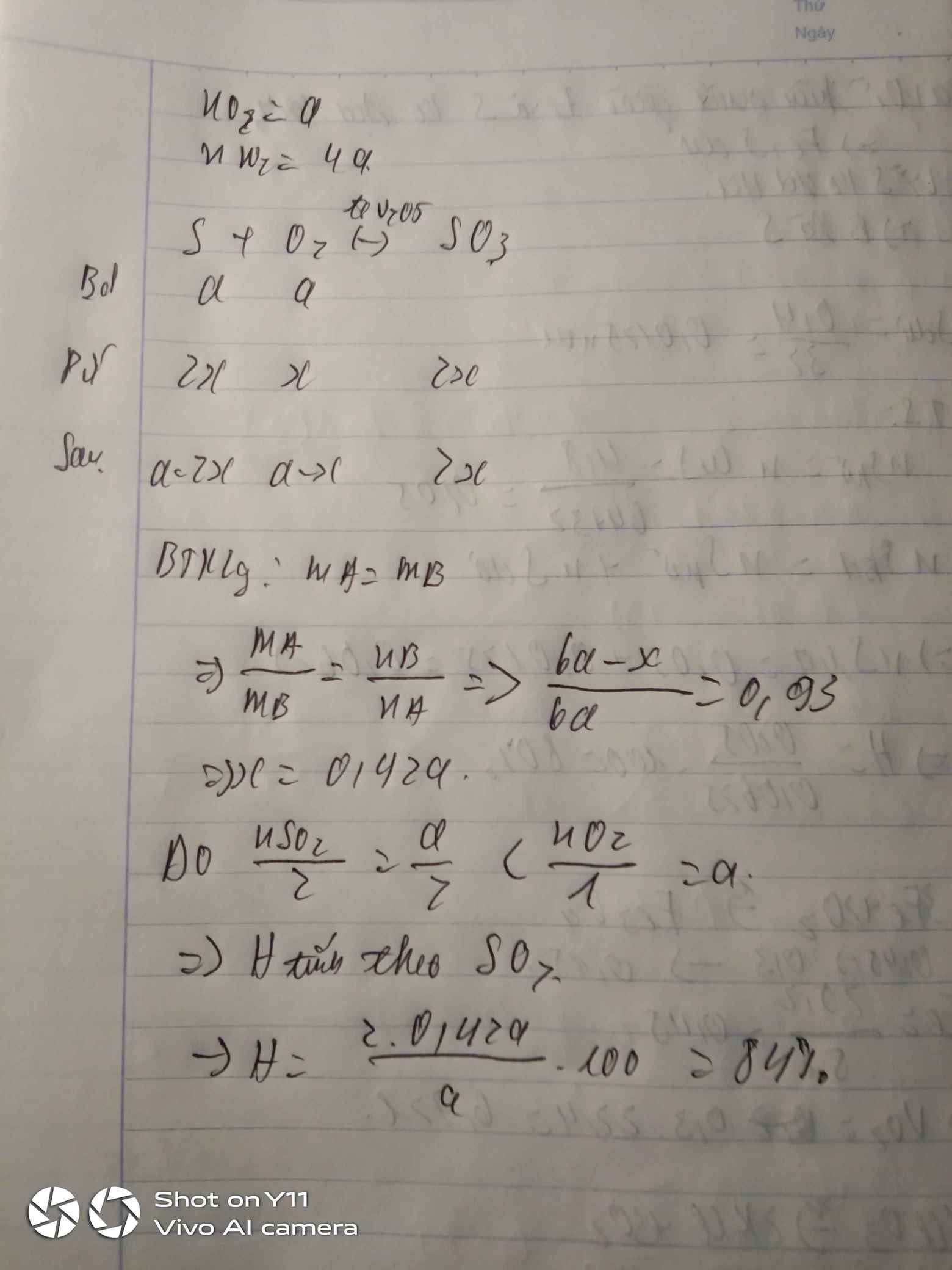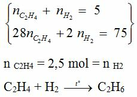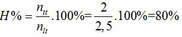Hỗn hợp A gồm SO2 và O2, tỉ khối hơi của A với hidro là 24. Sau khi nung có xúc tác thích hợp, ta thu được hỗn hợp khí B, tỉ khối hơi của B đối với hidro là 30.
a, Viết phương trình phản ứng
b, Tính % thể thích các khí trong hỗn hợp trước và sau phản ứng
c, Tính % thể tích mỗi khí tham gia phản ứng